研究内容Research projects
- がん幹細胞研究 ーこれまでに無かった新しいがん研究への挑戦ー
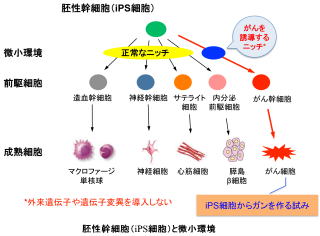 人工多能性幹細胞(iPS細胞)を作り出す技術が2006年に開発されて以来、再生医療技術の発展に拍車がかかりました。iPS細胞はどのような細胞にでも分化できる万能才能で、神経・筋肉、血液などを構成する様々な細胞へ分化させることができる細胞と言えますが、この分化を自在にコントロールするにはその条件を把握することが最も重要です。私たちは、このiPS細胞の万能性を利用して、がん細胞の素となるがん幹細胞を作り出す技術の研究を行っています。外来遺伝子の導入や遺伝子変異の導入を意図的には行わないのがこの技術の基本であり、大きな特徴です。この意味で、がん幹細胞の作成は、いわゆる「形質転換」とは区別されるべきもので、私たちは、幹細胞からの分化の一つに位置付けて考えています。
人工多能性幹細胞(iPS細胞)を作り出す技術が2006年に開発されて以来、再生医療技術の発展に拍車がかかりました。iPS細胞はどのような細胞にでも分化できる万能才能で、神経・筋肉、血液などを構成する様々な細胞へ分化させることができる細胞と言えますが、この分化を自在にコントロールするにはその条件を把握することが最も重要です。私たちは、このiPS細胞の万能性を利用して、がん細胞の素となるがん幹細胞を作り出す技術の研究を行っています。外来遺伝子の導入や遺伝子変異の導入を意図的には行わないのがこの技術の基本であり、大きな特徴です。この意味で、がん幹細胞の作成は、いわゆる「形質転換」とは区別されるべきもので、私たちは、幹細胞からの分化の一つに位置付けて考えています。
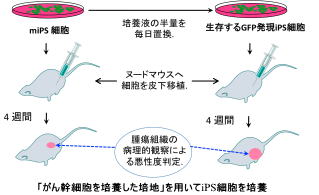
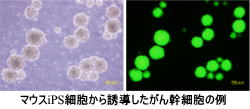
現段階で、マウスおよびヒトのiPS細胞からがん幹細胞を作り出すことに成功しています。このがん幹細胞を誘導する条件には、がん細胞株の培養上清を利用していますが、現在この中に含まれる原因因子の解析を行っています。 また、これまでの研究から、がん幹細胞は複数種類の存在が明らかとなりました。このことから類推すると、iPS細胞の万能性を利用することであらゆる全てのがん幹細胞を作成できる可能性が予想されます。私たちは、このあらゆる全てのがん幹細胞を準備してコレクションとし、これまでにない新しいがん研究の分野を創造していきます。すでに、がんが日本人の疾病による死亡率の第1位を占めて30年以上が経過していますが、この死亡率は現在も上昇しています。 これは、これまでのがん研究に不足していた概念が存在することを示唆していますが、私たちのがん幹細胞を作成する技術と作成されたがん幹細胞を利用することで、今までになかった治療法の開発や制がん剤の開発が実現できると考えられます。
- 組織や細胞のプロファイリング技術の研究
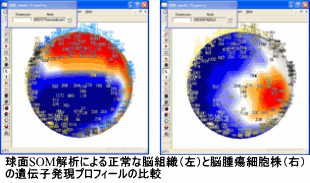 DNAマイクロアレイの解析結果をわかりやすく表現するために、自己組織化マップ(SOM)でクラスタリングを行い、その結果を球面上も表現して細胞や組織の特徴を視覚的に把握する試みを行っています。この方法は、DNAマイクロアレイだけではなく、大量データを解析してデータマイニングを行う場合に有効です。上記のがん幹細胞の分類等に利用しています。ヒト脳腫瘍細胞株の遺伝子発現プロフィールを本方法で解析してCD44が高発現していることを見出した実績もあります。
DNAマイクロアレイの解析結果をわかりやすく表現するために、自己組織化マップ(SOM)でクラスタリングを行い、その結果を球面上も表現して細胞や組織の特徴を視覚的に把握する試みを行っています。この方法は、DNAマイクロアレイだけではなく、大量データを解析してデータマイニングを行う場合に有効です。上記のがん幹細胞の分類等に利用しています。ヒト脳腫瘍細胞株の遺伝子発現プロフィールを本方法で解析してCD44が高発現していることを見出した実績もあります。
- リポソームと分子標的技術を組み合わせるドラッグデリバリーシステム技術の研究
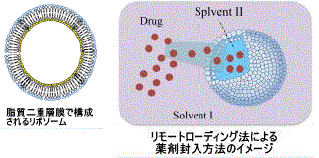 ドラッグデリバリーシステムとは、生体内の病巣へ薬を送り届ける技術です。細胞や組織に正確に薬剤を送り届けることにより、副作用を少なく効果を最大限に引き出すことが可能になると期待されています。私たちは、脂質で形成される直径100~200nmのリポソーム(ナノカプセル)の中に、溶解度差を利用するリモートローディング法などにより制がん剤を効率よく封入する方法の開発をはじめとして、
ドラッグデリバリーシステムとは、生体内の病巣へ薬を送り届ける技術です。細胞や組織に正確に薬剤を送り届けることにより、副作用を少なく効果を最大限に引き出すことが可能になると期待されています。私たちは、脂質で形成される直径100~200nmのリポソーム(ナノカプセル)の中に、溶解度差を利用するリモートローディング法などにより制がん剤を効率よく封入する方法の開発をはじめとして、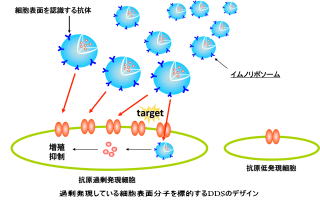 種々の細胞表面抗原を標的するための技術を開発し、in vivoで副作用が少なく効率よく機能するドラッグデリバリーシステムの技術を研究しています。これまでに、制癌剤として、シスプラチン、糖付加型パクリタキセル、ドセタキセルなどを効率よく封入することに成功しています。また、細胞表面抗原として、乳がんで有名なHER2やメタロマトリックスプロテアーゼの標的にも成功しています。
種々の細胞表面抗原を標的するための技術を開発し、in vivoで副作用が少なく効率よく機能するドラッグデリバリーシステムの技術を研究しています。これまでに、制癌剤として、シスプラチン、糖付加型パクリタキセル、ドセタキセルなどを効率よく封入することに成功しています。また、細胞表面抗原として、乳がんで有名なHER2やメタロマトリックスプロテアーゼの標的にも成功しています。
- 幹細胞の分化増殖を制御する研究
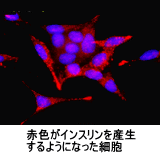 膵内分泌細胞の分化誘導:現代成人病の代表ともいわれる「糖尿病」では、膵内の内分泌細胞であるβ細胞のインスリン産生能力が低下します。このβ細胞を再生する因子としてベータセルリンが知られていますが、私たちは、この因子の遺伝子組換え体を調整する技術から、これに遺伝子の変異を加えて、β細胞の前駆細胞を成熟させる活性だけをもつ新規分子をデザインすることに成功しています。これまでは、ラットのがん細胞株やラットの個体を用いた研究が主でしたが、このベータセルリンをiPS細胞(幹細胞)へ応用してβ細胞への分化誘導を試みようと考えています。
膵内分泌細胞の分化誘導:現代成人病の代表ともいわれる「糖尿病」では、膵内の内分泌細胞であるβ細胞のインスリン産生能力が低下します。このβ細胞を再生する因子としてベータセルリンが知られていますが、私たちは、この因子の遺伝子組換え体を調整する技術から、これに遺伝子の変異を加えて、β細胞の前駆細胞を成熟させる活性だけをもつ新規分子をデザインすることに成功しています。これまでは、ラットのがん細胞株やラットの個体を用いた研究が主でしたが、このベータセルリンをiPS細胞(幹細胞)へ応用してβ細胞への分化誘導を試みようと考えています。
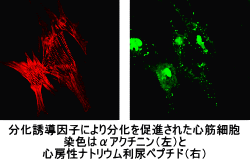 心筋細胞の分化誘導:ヒトの白血球が持つ因子(CmDF)に細胞分化を誘導する活性を見出し、これを再生医療へ応用する研究を行ってきました。心筋細胞の分化誘導促進活性は、心筋症への応用を目的として、その作用メカニズムを研究中です。下の動画は、マウスの胚性腫瘍細胞株P19をCmDFを用いて心筋細胞へと分化させたものを撮影したものです(m4v形式。Google Chromeでの再生を確認済み)。また、CmDFは種々の細胞への効果を示すことを示唆するデータも得られています。iPS細胞などを用いて、再生医療への応用にも可能性を広げていきたいと考えています。
心筋細胞の分化誘導:ヒトの白血球が持つ因子(CmDF)に細胞分化を誘導する活性を見出し、これを再生医療へ応用する研究を行ってきました。心筋細胞の分化誘導促進活性は、心筋症への応用を目的として、その作用メカニズムを研究中です。下の動画は、マウスの胚性腫瘍細胞株P19をCmDFを用いて心筋細胞へと分化させたものを撮影したものです(m4v形式。Google Chromeでの再生を確認済み)。また、CmDFは種々の細胞への効果を示すことを示唆するデータも得られています。iPS細胞などを用いて、再生医療への応用にも可能性を広げていきたいと考えています。