研究室概要
がん免疫療法と本講座の取組み
固形がんの治療は外科的切除、化学療法、放射線療法に加えて免疫療法が既に登場しています。免疫療法は抗体医薬としての免疫チェックポイント阻害薬(ICI)が広く使用されていますが、単剤での奏功率は概ね20~30%に留まっており、がん患者のニーズを十分に満たしているとは言えない状況です。奏功率の上昇を求めて複数種類のICIの併用、或いはICIと抗がん剤の併用療法が行われていますが、有害事象の問題も一部で指摘されています。
この様な状況下、より有害事象が少なく、且つ、奏功率を大幅に上昇させる、さらには完全寛解を見込める薬剤の開発が強く望まれています。私たちは動物モデルにおいてICIの一つである抗PD-1抗体(αPD-1)と併用することで格段に抗腫瘍効果を上昇させる低分子化合物として糖尿病治療薬であるメトホルミン(Met)が存在することを明らかにしてきました。αPD-1とMetはそれぞれ単剤でもそれなりの抗腫瘍効果が認められますが、併用すると優れた相乗効果があるという事です。(αPD-1+Met)の併用治療は固形腫瘍内のエフェクターCD8T細胞(CD8TILs)の数を著しく増やすこと、またIFNγ, IL-2, TNFαなどのサイトカイン産生を亢進して腫瘍の増大を抑制することを見出し、さらにその分子機構を明らかにしてきました(図1)。
しかし(αPD-1+Met)の併用治療の効果は、残念ながらそれ程長くは持続せず、次第に腫瘍の増大を見るに至り、完全寛解をもたらすには十分ではないことも岡山大学病院での医師主導治験、及びマウスモデルの研究でわかってきました。これはがん細胞が免疫治療に対して耐性になることに起因しており、他の多くのがん免疫治療においても見られる共通の事象(獲得耐性)であると考えられます。
がん細胞の獲得耐性に至るメカニズムの解明とその克服を目指して、我々の「代謝免疫制御学講座」は開設されました。固形がんの制圧に大きく貢献できる新たな創薬シーズに関する研究開発も併せて行なっていきます。
CD8TILsとがん細胞の代謝競合から見たがん免疫治療
私達はCD8TILsのエネルギー代謝ががん細胞よりも高い場合にがんは縮小し、逆に低いとがんは増大するという事実に、固形腫瘍の免疫治療に関する重要なヒントが隠されていると考えています。
エネルギー代謝とは、具体的には細胞質の解糖系とミトコンドリアのクエン酸回路に続く酸化的リン酸化の2つです。これらの代謝は栄養素の取り込みによって駆動します。栄養素は多数ありますが、特に重要なものはグルコースです。グルコースは解糖系を動かし、アセチルCoAとなってミトコンドリア内でクエン酸回路に入り、結果的に酸化的リン酸化を促進します。CD8TILsのサイトカイン産生と増殖は解糖系とクエン酸回路の双方に依存しますが、これはグルコースの重要性と一致しています。がん細胞の増殖、生存にもグルコースが必須です。従って、グルコースをCD8TILsとがん細胞のどちらがより多く消費できるかで予後はある程度決定される訳です(CD8TILsとがん細胞のグルコースを巡る代謝競合)。
腫瘍局所は低酸素の状態ですが、低酸素が進めばがん細胞の酸化的リン酸化能は低下し、その結果代償的に解糖能は上昇し、よりグルコース獲得能の高い、即ちより悪性度の高い治療抵抗性のがん細胞(獲得耐性株)へと変化していきます。こうなると腫瘍局所のグルコース濃度は極端に低下し、CD8TILsはグルコース欠乏状態のために機能喪失と細胞死に陥ることになります。ここで、腫瘍内の低酸素は腫瘍血管の特殊性に起因しています。腫瘍血管では血液の灌流が著しく損なわれており、その結果、酸素の運搬に大きな支障をきたしています。(αPD-1+Met)の併用治療では、腫瘍血管のVE-cadherinの発現を増やし、血管内皮細胞同士の結合を強固にします。また、周皮細胞(pericyte)が内皮細胞を裏打ちすることで血管壁に弾力性が担保されて血流の増加と酸素運搬が回復します。このような腫瘍血管の正常化は、CD8T細胞の血管壁を通して固形腫瘍内に浸潤する際にも重要です。CD8T細胞が分泌するTNFαとIFNγに依存して内皮細胞はVCAM-1を発現し、ここを足場にCD8T細胞は腫瘍内に入ります(図2)。MetはIFNγの効果と相乗効果を示し、VE-cadherinとVCAM-1の発現をさらに上昇させる働きがあります。
上記はがん細胞と免疫の関係を示す最もシンプルな説明ですが、治療方針を考える上では極めて重要です。つまり如何にして腫瘍局所のグルコース濃度と酸素濃度を上げ、CD8TILsに優先的にグルコースと酸素を届けることができるかが重要です。私達はこの様な視点に立って、固形がんの免疫治療研究を行なっています。
メトホルミンによるミトコンドリア活性酸素誘導を起点にしたCD8TILsの機能亢進と細胞増殖誘導
メトホルミンはCD8 TILsのミトコンドリア呼吸鎖Complex Ⅰを軽度に阻害し、微量の活性酸素(ROS)を産生させます。このROSはグルコーストランスポーターであるGlut-1を細胞膜上に誘導し、グルコース取り込みが上昇して解糖系が活性化します。解糖系の亢進はIFNγ産生を上昇させます。また、ROS はNrf2→オートファジー→グルタミノリシス→α-ケトグルタル酸(αKG) 産生→mTORC1→p62→Nrf2といった自己完結型のpositive feedbackループを稼働させることで細胞の増殖を維持します。さらに、抗PD-1抗体との併用によって、PI3K-Akt経路を介した解糖系のさらなる上昇も加わり、大量のIFNγが腫瘍局所で産生されます。このIFNγは腫瘍細胞の代謝を低下させ、その結果、CD8TILsの代謝が腫瘍細胞の代謝を上回り、腫瘍を退縮へと導いています。
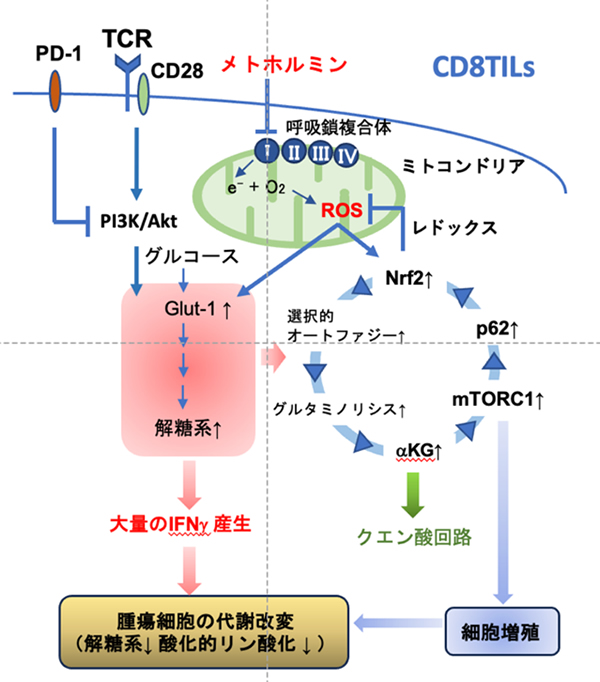
図1
メトホルミンと(αPD-1+Met)の併用療法による腫瘍血管正常化メカニズム
腫瘍血管は構造異常に陥り、VE-カドヘリンの発現は低く周皮細胞の被覆は軽微です。メトホルミンと抗PD-1 抗体治療によってCD8T細胞の機能が回復しIFNγを放出するようになります。IFNγシグナルを受けた腫瘍血管内皮細胞はVE-カドヘリンの発現を亢進し、内皮細胞同士を繋げるタイトジャンクションを形成することで破綻した血管の正常化に貢献します。さらにIFNγとTNFαによって血管内皮細胞上のVCAM1の発現が亢進します。VCAM1はCD8T細胞のリガンドVLA4と反応するとシグナルを伝達させ、VE-カドヘリンを内在化(internalization)させてCD8 T細胞が入ってくるためのゲートを開きます。CD8 T細胞の通過が終了すると素早くそのゲートは閉じると考えられるため、腫瘍血管の恒常性は保たれます。また、メトホルミンが血管内皮細胞に直接作用し、VE-カドヘリンやVCAM1の発現亢進に寄与している可能性も見出しました。
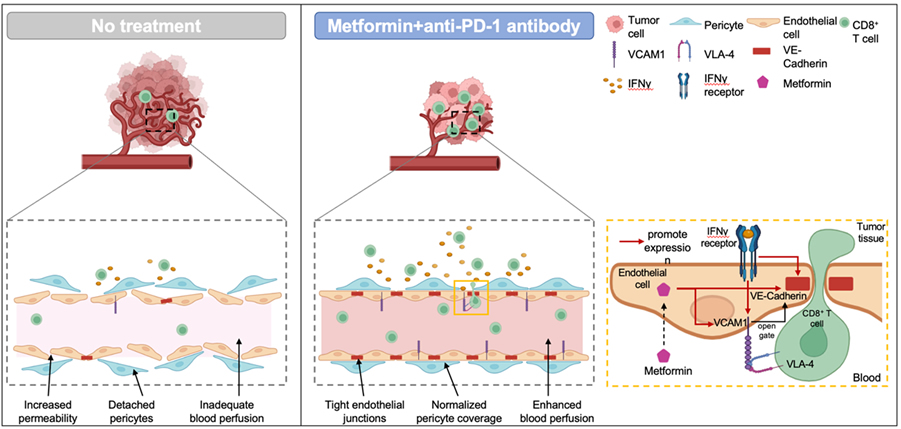
図2